Benzothioxanthène imide
| Benzothioxanthène imide | |

| |
| Structure du benzothioxanthène imide | |
| Identification | |
|---|---|
| Nom UICPA | N-(alkyl)benzothioxanthène-3,4-dicarboximide |
| Nom systématique | Benzothioxanthène imide |
| Synonymes |
BTXI |
| Propriétés chimiques | |
| Formule | C23H18NO2S |
| Masse molaire[1] | 372,46 ± 0,025 g/mol C 74,17 %, H 4,87 %, N 3,76 %, O 8,59 %, S 8,61 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le benzothioxanthène imide (BTI) est un colorant jaune de la famille des rylènes (en). C'est un composé aromatique polycyclique de formule C23H18NO2S, comprenant notamment un groupe imide et un hétérocycle soufré (thiopyrane/thioxanthène). Il est connu pour ses propriétés optiques, luminescence et fluorescence, dues aux transitions électroniques avec les orbitales . On les retrouve ainsi dans différentes utilisations, comme la thérapie photodynamique, la fabrication de dispositifs OLED, ou la fabrication de cellules photovoltaïques organiques[2],[3],[4].
Propriétés[modifier | modifier le code]
Spectroscopie d'absorption[modifier | modifier le code]
Le BTI (et ses dérivés) possède une vaste système 𝜋 conjugué, avec une forte délocalisation de son nuage électronique pouvant entrer en résonance avec un rayonnement incident. Ainsi, le groupement chromophore rylène est responsable de l'absorption et confère sa couleur à la molécule. Le spectre d'absorption présente une large bande entre 400 et 500 nm avec un maximum d'absorption à 455 nm[2]. Le noyau du BTI possède ainsi un coefficient d'extinction molaire élevé dans la partie bleue du spectre électromagnétique ce qui explique la couleur jaune de la molécule. Cette bande d'absorption correspond à une excitation électronique de type → *.
Spectroscopie d'émission[modifier | modifier le code]
Le BTI possède des rendements quantiques d'émission presque unitaires dans le domaine jaune-vert[5].
Sous irradiation UV à 𝜆 = 470 nm, le BTI est de couleur vert fluorescent et sa longueur d'onde d'émission est de 502 nm.
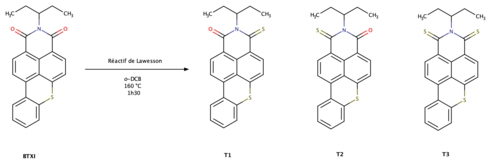
On peut le différencier de certains de ses dérivés, les BTI thiocarbonylés (T1, T2, T3), qui sous rayonnement UV, ne sont pas fluorescents. En effet, pour ces composés, en raison du croisement intersystème se produisant entre l'état singulet S1 et triplet T1, un phénomène de « quenching » de fluorescence est observé[2].
La fluorescence du BTI est plus forte dans un milieu hydrophobe que dans un solvant protique fort ou hydrophile[6].
De façon plus générale, la photophysique à l'état excité des chromophores de même type que celui de BTI est très sensible au modèle de substitution. En effet, pour faciliter la conversion intersystème, l'ajout d'halogènes est bien connu, mais il se trouve que la substitution du BTI par de simples groupes fonctionnels, nitro, amine ou encore diphénylamine, contribue également à rendre ce processus plus efficace[5].
L'introduction du groupement -nitro dans le composé BTI-NO2 entraîne une distorsion du squelette de la molécule qui perturbe la forme et l'énergie des orbitales frontières. L'état excité S1 y est alors décrit par une transition n*, normalement interdite par symétrie[5]. Ceci conduit alors à une augmentation du couplage spin-orbite (SOC) car la transition n* voit son niveau énergétique s'abaisser, diminuant ainsi les écarts énergétiques singulet-triplet.
Les modifications chimiques et structurelles sur le motif BTI sont très utiles pour ajuster l'étendue de la conversion intersystème au sein de la molécule, ce qui permet d'augmenter et d'atteindre un rendement quantique très proche de l'unité dans la formation d'états triplets[2].
Propriétés électrochimiques[modifier | modifier le code]
Grâce à la technique de voltampérométrie cyclique, il est possible de voir que le BTI est siège d'une réaction d'oxydation réversible ainsi que d'une réduction réversible, lui conférant un caractère ambipolaire stable[3]. Il permet également une forte mobilité électronique.
D'autre part, les réactions de thionation successives de BTI sont très intéressantes car elles entraînent une réduction de la bande interdite électrochimique sans toucher aux propriétés de double oxydo-réduction de celui-ci[2].
Synthèse[modifier | modifier le code]
La synthèse du benzothioxanthène imide a été réalisée pour la première fois en 1974 par Grayshan, Khadim et Petters. Cette synthèse est composée de trois étapes fondamentales[3],[4].
La première étape de la synthèse implique une réaction de substitution nucléophile aromatique (SNAr) entre l'anhydride naphtalique fonctionnalisé par un groupe partant (Cl, NO2 ou Br) et le 2-aminothiophénol (en) en milieu basique, réaction qui permet d'introduire le groupe éther de thiophénol sur le naphtalène. La réaction se poursuit par une cyclisation de Pschorr (en), une réaction de cyclisation intramoléculaire qui permet de transformer l'éther de naphtylthiol issu de la SNAr en benzothioxanthène. Lors de la première étape (SNAr), un sel de diazonium est formé par la réaction entre l'intermédiaire formé et le nitrite de sodium en milieu acide ; grâce à une catalyse au cuivre, un radical est généré et mène à la précipitation du benzothioxanthène anhydride (BTA) sous la forme d'une poudre orange. Enfin, la réaction de condensation entre le BTA synthétisé et le 3-aminopentane (en) dans l'éthanol conduit à la formation du BTI[3],[4].

Amélioration de la synthèse[modifier | modifier le code]
La synthèse du BTI a été améliorée par le groupe de C. Cabanetos pour devenir plus efficace, rapide et permettre d'augmenter le rendement. Tout d'abord, la synthèse sous micro-onde permet de diminuer le temps de réaction et de réduire le nombre d'étapes de deux en une seule, par ajouts successifs des réactifs lors de l'étape de préparation de l'anhydride[4],[7]. De plus, la cyclisation de Pschorr, qui est réalisée habituellement dans des conditions fortement acides, peut être simplifiée grâce à l'utilisation du nitrite d'isoamyle[7]. Cette alternative permet de s'affranchir des conditions acides et métallo-catalysées lors de la réaction. Pour obtenir un rendement satisfaisant l'éthanol peut être remplacé par l'imidazole. L'utilisation de l'imidazole comme le solvant (une fois chauffé au-dessus de 91 °C) et la base permet d'obtenir un rendement d'environ 70%[3],[4]. Cependant, pour atteindre un rendement satisfaisant, le mélange réactionnel doit être chauffé à 140 °C pendant au moins cinq heures. L'utilisation du 2-éthoxyéthanol, solvant polaire et à haute température d'ébullition (135 °C) permet d'atteindre des rendements comparables à ceux obtenus avec l'imidazole. Cependant, une distinction importante réside dans le fait que le 2-éthoxyéthanol peut être facilement éliminé par des cycles de lavage successifs lors de l'étape d'extraction[4].

Synthèse de dérivés[modifier | modifier le code]
Synthèse du 10-bromo-14-pentan-3-yl-8-thia-14-azapentacyclo[10.6.2.02,7.09,19.016,20]icosa-1(19),2,4,6,9,11,16(20),17-octaene-13,15-dione[modifier | modifier le code]
Le BTI-Br est l'un des dérivés du benzothioxanthène imide (BTI). Il est essentiel dans la formation de certains dérivés du BTI et est engagé en tant que réactif dans diverses réactions de couplage synthétiques catalysées par des métaux, notamment les réactions de Sonogashira, de Suzuki–Miyaura, de Stille et de couplage direct (hétéro)arylation.
Le BTI-Br est un composé monobromé synthétisé par le groupe de C. Cabanetos lors de la réaction de bromation entre le benzothioxanthène imide et le dibrome dans le dichlorométhane à température ambiante. Prenant en compte la grande réactivité du BTI vis-à-vis du dibrome, seul un équivalent de Br2 est nécessaire pour l'obtention du BTI-Br avec un rendement de 93%[3]. L'augmentation de la concentration de Br2 n'implique pas la formation des nouvelles espèces, ceci accélère seulement la réaction de formation du produit monobromé, BTI-Br, toujours avec un excellent rendement.
Par ailleurs, il existe d'autres méthodes moins dangereuse de synthèse du BTI-Br également publiées par le groupe de C. Cabanetos. Le dibrome peut être remplacé par le perbromure de pyridinium (en) (C₅H₆Br₃N), qui est un solide moins dangereux à manipuler. Cependant, une plus grande quantité de perbromure de pyridinium est nécessaire[8],[9].

Synthèse du thiochroménocarbazole imide[modifier | modifier le code]
La synthèse du thiochroménocarbazole imide (TCI), composé « N-annulé » du BTI se déroule en plusieurs étapes. Publiée par le groupe de C. Cabanetos, un dibrome est utilisé pour effectuer une monohalogénation sélective du BTI et protéger la position la plus réactive en 𝑎 du soufre sur le noyau naphtalène. Cette étape permet une mononitration sur la position opposée, appelée position « baie ». En traitant le BTI-Br avec de l'acide nitrique, on obtient le NO2-BTI-Br, qui est ensuite engagé dans une réaction de réduction catalysée en présence de triphénylphosphine. Cela entraîne une cyclisation intramoléculaire de type Cadogan-Sundberg (en), favorisant la formation du dérivé carbazole. L'alkylation du dérivé carbazole permet de positionner des groupes fonctionnels spécifiques. Enfin, pour achever la synthèse du TCI, la position préalablement protégée avec le dibrome, est déprotégée par une réduction palladocatalysée, finalisant ainsi la structure désirée du thiochroménocarbazole imide[3],[10].

Autres dérivés du benzothioxanthène imide[modifier | modifier le code]
Les dérivés sulfonés (BTI-SO2, BTI-SO2-NO2, BTI-SO2-Br, BTI-SO2-BrBr, BTI-SO2-I) sont simplement obtenus en faisant réagir le BTI avec l'acide métachloroperbenzoïque (mCPBA) dans le dichlorométhane à température ambiante. La réaction est ensuite arrêtée avec une solution saturée de thiosulfate de sodium (Na2S2O3). La phase organique est ensuite extraite avec du dichlorométhane, lavée avec une solution saturée de bicarbonate de sodium (NaHCO3), séchée avec du sulfate de magnésium MgSO4 et finalement concentrée sous vide[5].

Applications[modifier | modifier le code]
Médecine[modifier | modifier le code]
Le BTI agit comme un photosensibilisateur en thérapie photodynamique (PDT). En effet, La monothionation sélective du benzothioxanthène imide, démontrée par le groupe de C. Cabanetos (composés T1, T2, T3), permet la formation d'états triplets fortement peuplés. Ces derniers permettent la formation à la fois d'oxygène singulet et d'ions superoxydes O2-.. L'efficacité de cette méthode à été démontrée pour la forme monothionée notée T2 sur des cellules cancéreuses HeLa, car elle présente une plus grande efficacité photothérapeutique et engendre une plus grande quantité de dérivés réactifs de l'oxygène (DROs)[2].
La molécule de BTI a également été utilisée dans le traitement du DMLA (dégénérescence maculaire liée à l'âge)[7].
Composés opto-électroniques[modifier | modifier le code]
Des recherches récentes menée par le groupe de C. Cabanetos ont permis de trouver de nombreuses applications au benzothioxanthène imide dans les composés opto-électroniques grâce à sa structure 𝜋-conjuguée et ses propriétés de photoluminescence[3].
Diodes électroluminescentes organiques (OLEDs)[modifier | modifier le code]
Le dérivé NO2-BTI-Br peut être entraîné dans une réaction de Cadogan afin de créer un nouveau composé, le thiochroménocarbazole imide (TCI). La dimérisation de ce dernier (TCI2) se montre utile dans la fabrication de diodes électroluminescentes flexibles et imprimées lorsqu'il est incorporé dans la couche d'émission de ces dispositifs[10].

Cellules photovoltaïques organiques (OSCs)[modifier | modifier le code]
Il est possible former le dérivé indancénodithiophène-benzothioxanthène (IDT-BTI) par hétéroarylation directe de BTI-Br. Ce nouveau dérivé peut être utilisé en tant que matériau donneur d'électrons dans des cellules à hétérojonction volumique d'architecture PBDB-T/IDT-BTI/PC61BM ou des cellules ternaires (ITO/ZnO/couche active/MoO3/Ag) afin d'augmenter légèrement sa tension de circuit ouvert notée Voc (supérieure à 1 Volt)[3],[4].
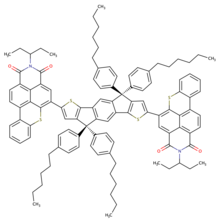
La fabrication de cellules solaires est également envisageable avec le dérivé BTI-DPP(R)-BTI (R correspondant à une chaîne 2-éthylhexyle). En effet, le dérivé présente des propriétés photovoltaïques suffisamment intéressantes et similaires au dérivé IDT-BTI pour l'incorporer en tant que matériau donneur au sein de cellules solaires[3].

Transistors à effet de champs (OFETs)[modifier | modifier le code]
Avec le dérivé dicétopyrrolopyrrolé BTI-DPP(R)-BTI, préparé en effectuant une hétéroarylation directe entre le dérivé bromé du BTI et le DPP(R) (avec R une chaîne n-octyle, activatrice du DPP), il est possible de fabriquer des transistors à effet de champs et plus particulièrement des transistors organiques en couche mince. Le composé BTI-DPP(R)-BTI présente des propriétés de transport d'électrons et de mobilité des trous importants et de même ordre de grandeur[3]. De ce fait, on obtient un transistor ambipolaire.

Par ailleurs, d'autres dérivés du BTI peuvent être utilisés en tant que sonde fluorescente[3].
Impact économique et écologique[modifier | modifier le code]
Le benzothioxanthène imide est utilisé initialement en tant que colorant jaune. Cette molécule présente aussi des avantages économiques, écologiques et sociétaux au niveau des différentes utilisations due à ses propriétés chimiques. En effet, le benzothioxanthène imide se forme en seulement deux étapes, avec des solvants éco-responsables. De plus, sa production est très bénéfique car elle présente un faible coût et peut être produite à grande échelle.
On retrouve notamment ses propriétés avantageuses sur un exemple d'utilisation du benzothioxanthène imide. Cet exemple repose sur l'utilisation du benzothioxanthène imide pour la thérapie photodynamique. De ce fait, pour mener à bien la thérapie photodynamique, il est nécessaire de modifier la molécule de benzothioxanthène imide avec la pratique du surcyclage. La technique du surcyclage (recyclage par le haut) est une technique permettant de transformer des composés ou matériaux pour améliorer leurs valeurs dans l'industrie de production de masse. Ainsi, l'usage du surcyclage sur le benzothioxanthène imide va permettre de modifier chimiquement la molécule afin de la transformer en photosensibilisateur à partir de ses propriétés de fluorescence. Cette technique de thérapie photodynamique à partir du benzothioxanthène imide présente des avantages à tout échelle grâce à l'usage de la technique du surcyclage, afin d'améliorer les propriétés de la molécules et répondre aux attentes du marché de la production de masse[7].
Références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Marco Deiana, Cyrille Monnereau, Nasim Sabouri et Clément cabanetos, « Site-selected thionated benzothioxanthene chromophores as heavy-atom-free small-molecule photosensitizers for photodynamic therapy », Communications Chemistry, vol. 5, no 1, , p. 1–11 (ISSN 2399-3669, PMID 36697939, PMCID PMC9814739, DOI 10.1038/s42004-022-00752-x, lire en ligne, consulté le )
- Pierre Josse, Matériaux dérivés de colorants pour le photovoltaïque organique, Angers, Université d'Angers, , 130 p. (lire en ligne)
- (en) Pierre Josse et Clément Cabanetos, « Revisiting the synthesis of the benzothioxanthene imide five decades later », New Journal of Chemistry, vol. 46, no 18, , p. 8393–8397 (ISSN 1369-9261, DOI 10.1039/D2NJ00955B, lire en ligne, consulté le )
- Clément Cabanetos, Cyrille Monnereau et Tangui Le Bahers, « Theoretical and experimental investigation on the intersystem crossing kinetics in benzothioxanthene imide luminophores, and their dependence on substituent effects », Physical Chemistry Chemical Physics, vol. 22, no 22, , p. 12373–12381 (ISSN 1463-9084, DOI 10.1039/D0CP01072C, lire en ligne, consulté le )
- Ping Mao, Xuhong Qian, Huizhan Zhang et Wei Yao, « Benzothioxanthene dyes as fluorescent label for DNA hybridization: synthesis and application », Dyes and Pigments, vol. 60, no 1, , p. 9–16 (ISSN 0143-7208, DOI 10.1016/S0143-7208(03)00127-X, lire en ligne, consulté le )
- Clément Cabanetos et Cyrille Monnereau, « Les dérivés du benzothioxanthène imide: de l'industrie textile à la thérapie photodynamique », L'actualité chimique, no 488, , p. 17-21 (lire en ligne
 [PDF])
[PDF])
- Pierre Josse et Clément Cabanetos, « Bromination of the benzothioxanthene Bloc: toward new π-conjugated systems for organic electronic applications », Journal of Materials Chemistry C, vol. 6, no 4, , p. 761–766 (ISSN 2050-7534, DOI 10.1039/C7TC05245F, lire en ligne, consulté le )
- (en) Arnaud Chevalier, « The how and why of naphthalimide/heterocycle-fused hybrid dyes: an overview of the latest developments in the quest for dyes with innovative optical properties », Organic & Biomolecular Chemistry, vol. 21, no 37, , p. 7498–7510 (ISSN 1477-0539, DOI 10.1039/D3OB01035J, lire en ligne, consulté le )
- (en) Gregory Welch et Clément Cabanetos, « Thiochromenocarbazole imide: a new organic dye with first utility in large area flexible electroluminescent devices », Materials Chemistry Frontiers, vol. 6, no 14, , p. 1912–1919 (ISSN 2052-1537, DOI 10.1039/D2QM00299J, lire en ligne, consulté le )


